Cedars-Sinai案例 | 脑芯片增强iPSC分化的多巴胺能神经元成熟
很高兴与大家分享Cedars-Sinai医学中心Clive N.Svendsen教授团队在<International Journal of Molecular Sciences>上发表的一篇论文。该论文基于Emulate器官芯片技术重建脑芯片,发现在生物力学刺激下,脑芯片上培养的多巴胺能神经元的比例更高、更均匀,成熟标志物的水平也更高。它是研究成熟多巴胺能神经元的理想平台,可以更好地了解它们在健康和神经系统疾病中的生物学特征。
背景简介:
人类诱导多能干细胞(iPSCs)为更好地理解人类生物学提供了一个强大的平台,来自患者的iPSCs也可用于忠实的疾病建模。然而,传统的二维培养模型缺乏体内三维多细胞复杂性。为了使多能干细胞产生与健康和疾病中发现的细胞相似的成熟细胞表型,可能需要使用三维系统,如类器官和微流控器官芯片平台。
生物相容性材料和微工程技术的结合使微流体器官芯片的发展成为可能。器官芯片的设计目的是在一个完全集成的系统中生长多种器官特异性细胞类型。不同类型的细胞通常在由含有微通道的多孔膜连接的两个独立隔室中培养。由于人体不是一个静态系统,而是由流动的血管灌注的,因此器官芯片比二维培养具有更多优势,因为它们允许液体在细胞之间流动。
多巴胺能神经元在自主运动和各种行为过程中起着至关重要的作用,如情绪、奖励和成瘾。此外,多巴胺的变化也是各种神经系统疾病的基础,如注意力缺陷障碍、精神分裂症和帕金森病(PD)。尽管人类多巴胺能神经元已在二维平台上广泛培养,但这些神经元可能还不够成熟,无法忠实地再现健康和患病状态。在这项研究中,科学家们将人类iPSC分化为多巴胺能神经元,并将传统的二维培养系统与Emulate器官芯片系统进行了比较。基于免疫荧光和单核RNA测序(snRNA-seq),科学家们发现,Emulate器官芯片平台可以提高培养中多巴胺能神经元的成熟度和均匀性。人类iPSC衍生的多巴胺能神经元器官芯片的开发可以为该领域提供成熟的多巴胺能神经细胞,从而更好地了解它们在健康和疾病中的生物学特性。
1、星形胶质细胞可提高多巴胺能神经元的存活率
为了确定多巴胺能神经元在传统二维Transwell模型或器官芯片培养物中的存活情况,科学家将人类iPSC分化为多巴胺能神经元祖细胞15天,然后收集并低温储存,直到随后解冻并接种到传统二维Transwell模型的玻璃盖玻片或Emulate器官芯片的顶部通道上。细胞储存在成熟的神经元培养基中。传统的二维Transwell模型培养基每两天更换一次,而器官芯片培养基以20µL/h的恒定速率运行。第28天,将样品固定用于免疫细胞化学分析或snRNA-seq分析(图1A)。
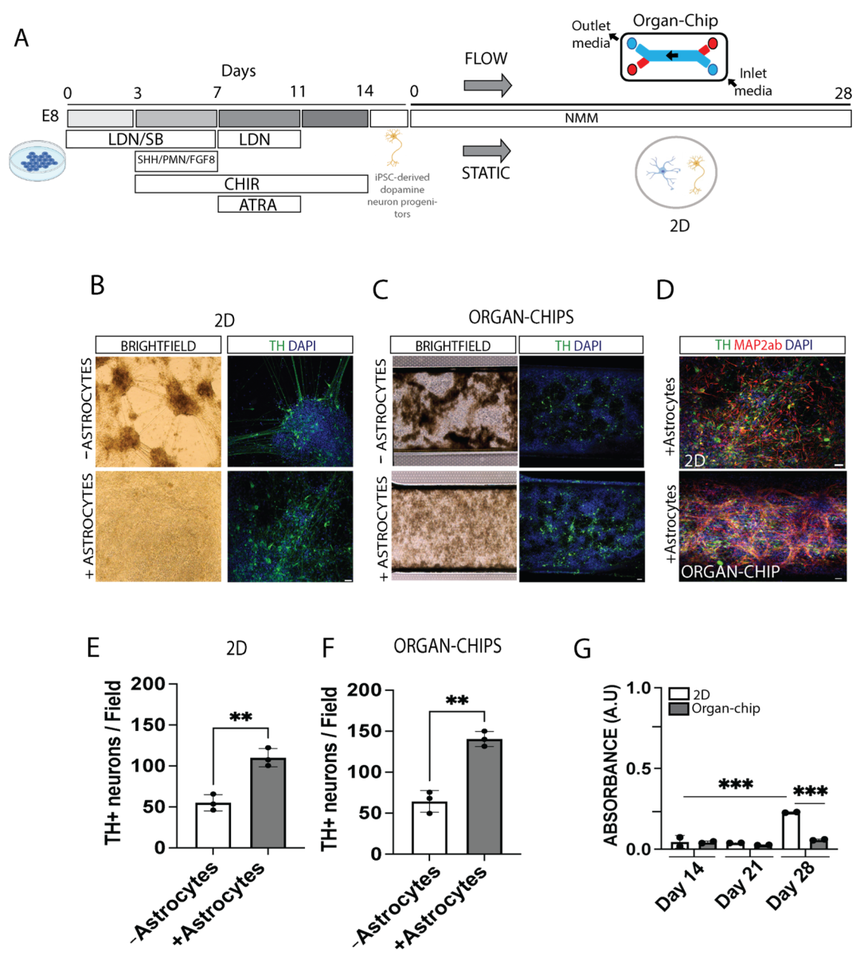
图1. 人类 iPSCs 可分化为多巴胺能神经元
在传统的二维Transwell模型和器官芯片中,活细胞的相位图像显示了许多团块。免疫荧光显示酪氨酸羟化酶(TH)阳性多巴胺能神经元的分布不均匀(图1B,C)。众所周知,星形胶质细胞在神经元的成熟和稳定性中起着重要作用,因此科学家将多巴胺能神经元祖细胞与从中脑分离的商用原代人类星形胶质细胞共培养。TH和神经元标记物MAP2ab的个体TH免疫组织化学分析和共染色表明,与星形胶质细胞共培养的多巴胺能神经元在整个二维孔培养和器官芯片中分布更均匀,纤维生长增加(图1B、C、D)。定量分析显示,与不含星形胶质细胞的共培养相比,与星形胶质细胞共培养的TH阳性细胞总数显著增加,并呈上升趋势。为了量化培养物随时间的健康状况,进行了乳酸脱氢酶(LDH)检测,结果表明,与早期时间点相比,传统的二维Transwell模型在第28天的细胞死亡比Emulate器官芯片培养显著增加(图1G)。
令人惊讶的是,尽管在实验开始时接种了星形胶质细胞,但在第28天只观察到极少数胶质纤维酸性蛋白(GFAP)阳性星形胶质细胞。科学家推测,星形胶质细胞未能存活是由于使用了含有有丝分裂抑制剂DAPT和缺乏血清的神经元成熟培养基。为了进一步研究这个问题,科学家们在专门针对星形胶质细胞的二维Transwell培养基或成熟神经元培养基中培养原代星形胶质细胞,并将其维持28天。在星形胶质细胞培养基中,GFAP阳性的星形胶质细胞存活,而在神经元培养基中虽然也有一些GFAP阴性和DAPI染色的细胞,但存活率大大降低。为了评估星形胶质细胞过度死亡的情况,将星形胶质细胞分别储存在神经元培养基中并进行LDH检测。结果显示,28天后星形胶质细胞死亡显著增加。由于神经元培养基中原代星形胶质细胞明显逐渐死亡,剩余的GFAP阴性细胞可能反映了其他类型的细胞,因为市面上可获得的星形胶质细胞尚未进行纯度分类。然而,鉴于共培养中星形胶质细胞的比例已经稀释,预计这种细胞亚群的数量不会太多。
2、与传统Transwell模型相比,Emulate器官芯片培养的多巴胺能神经元更佳
为了进一步表征和量化传统Transwell模型和器官芯片中的多巴胺能神经元,科学家们用星形胶质细胞生成了一组用于snRNA-seq的多巴胺能神经细胞培养物。经过质量过滤后,科学家分析了所有培养物中的5538个细胞核(传统Transwell模型中为3548个,器官芯片培养物中为1990个),平均每个细胞核检测到11156个读数和4227个基因。共鉴定出六个不同的基因簇(图2A)。正如预期的那样,在分化培养中几乎检测不到多能标记物(POU5F1、NANOG和KLF4)的表达(图2B)。在细胞簇2中发现了一些基于增殖标记MKI67、TOP2A和CENPF的分裂细胞(图2B)。仅检测到少量表达AQP4、S100B或GFAP的细胞(图2B),这证实了GFAP染色的缺失,并进一步表明星形胶质细胞可能无法在器官芯片中存活到终点。最后,为了进一步分析细胞身份,根据特定细胞类型标记的表达将细胞簇分为祖细胞和神经细胞身份(图2C)。多巴胺能祖细胞标志物SOX6、HES1和NFIA的表达鉴定了三个祖细胞群,而神经元成熟标志物RBFOX3、MAPT和SNAP25的表达鉴定出三个神经元群。
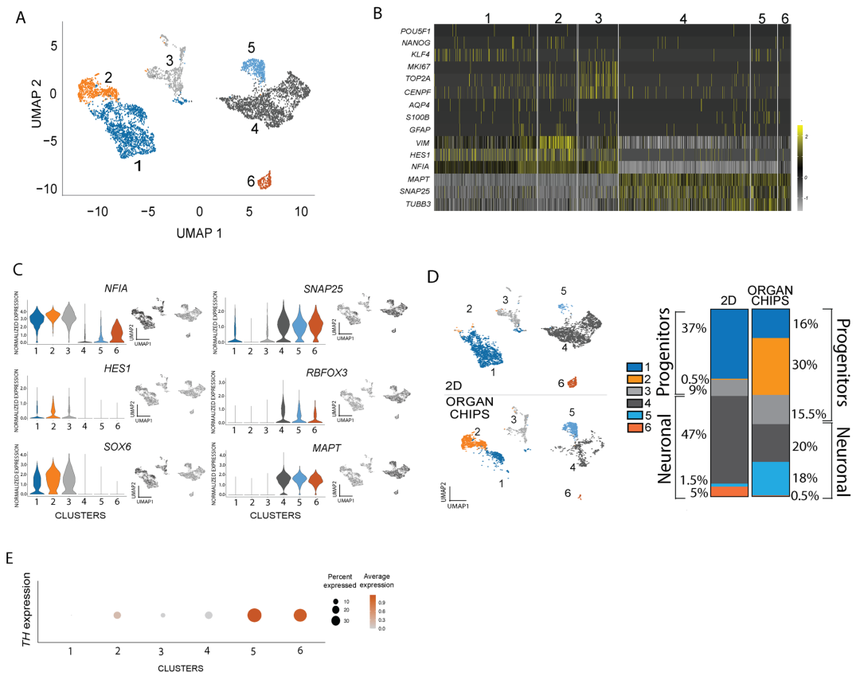
图2. 不同簇间多巴胺能神经元的不同亚型
为了分别评估传统Transwell模型和器官芯片中的神经元数量(图2D左),使用计算出的细胞总数中每个细胞群中的细胞数量来量化每个细胞群的比例(图2D右)。结果表明,器官芯片具有独特的祖细胞和神经元群。尽管细胞簇1和3的比例存在一些差异,但二维孔和器官芯片祖细胞之间的主要差异出现在细胞簇2中(二维孔0.5%,器官芯片30%),该细胞簇显示了底物标记CORIN1、LMX1A和FOXA2的最大组合。这表明器官芯片环境正在推动细胞走向多巴胺能命运发展。小鼠胚胎的单细胞RNA-seq分析表明,两组多巴胺能祖细胞表达相同的标记物(LMX1A/B、OTX2、NR4A2),其中一个群体产生多巴胺能神经元,另一个群体产生眼下核(STN)的谷氨酸能神经元。因此,科学家们评估了STN标记物(BARLH1、DBX1、WNT8B和PITX2)的表达,发现与多巴胺能标记物相比,在传统的Transwell模型或器官芯片培养中几乎检测不到转录水平。由于这些培养物中显示了多巴胺能祖细胞的表达标记,科学家随后量化了TH的表达(颜色强度)和每个细胞群中表达TH的细胞百分比(图2E)。结果显示,第5组约30%的细胞表达TH,第6组约20%的细胞表达TH。综上所述,这些数据表明,尽管二维孔培养中的神经元总数较多,但器官芯片中表达TH的神经元比例最高。然后,科学家们评估了不同培养物中细胞的总体表达(图3A)。由于传统孔平台产生了大量的神经元,但表达TH的神经元比例很小,科学家们希望研究这些神经元的特性。因此,科学家们评估了神经元标志物的基因表达水平,如胆碱能乙酰转移酶(CHAT,胆碱能神经元)、生长抑素(SST,抑制性神经元)、谷氨酸脱羧酶(GAD1,抑制性神经细胞)、TPH1和TPH2(5-羟色胺能神经元)以及SLC17A7和SLC17A8(谷氨酸能神经元)。抑制性神经元、5-羟色胺能神经元和谷氨酸能神经元的基因在传统的Transwell模型和器官芯片培养物中分布在各种簇中,而CHAT和SST在二维孔系统的群组6中高度富集(图3B)。总之,这些发现表明,尽管传统孔培养中神经元细胞的总体水平很高,但它们的特异性很低,其中大多数似乎是胆碱能细胞而不是多巴胺能细胞。
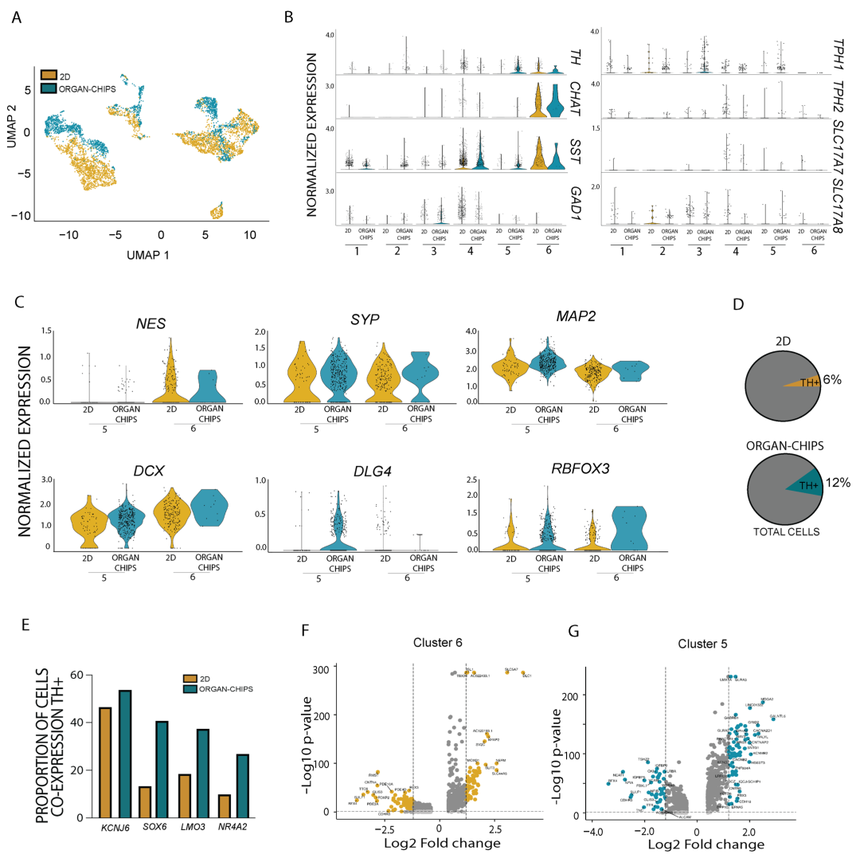
图3. 器官芯片与二维孔培养相比,多巴胺能神经元的比例和均匀性更高
进一步评估5组和6组之间的成熟标志物显示,与第5组(富集于器官芯片上)相比,第6组(富集于二维孔)神经祖细胞标记物Nestin(NES)和未成熟神经元标记物Doublecortin(DCX)的表达水平更高(图3C)。相比之下,第5组神经元成熟标志物DLG4、MAP2和RBFOX3的基因表达增加,而SYP在培养间保持稳定。比较TH阳性神经元总数的比例,发现器官芯片中TH阳性神经元的比例(12%)是二维孔系统中TH阳性神经元的比例(6%)的两倍(图3D)。科学家们接下来评估了TH与主要多巴胺能标记物的共同表达。虽然表达钾内向整流通道J亚家族成员6(KCNJ6)的TH阳性神经元比例在二维孔和器官芯片培养中相似(二维孔46.5% VS 器官芯片53.8%),但在器官芯片培养中表达SOX6的TH阳性细胞更多(二维孔13.4% VS 器官芯片40.75%),LMO3(二维 孔18.5% VS 器官芯片37.4%)和 NR4A2(二维孔9.91% VS 器官芯片26.9%)。这表明与传统的孔培养相比,器官芯片中的多巴胺能神经元中几种典型的A9多巴胺能标记物的表达升高(图3E)。最后,利用火山图分析评估5组和6组与所有细胞相比差异表达的标记物。群组6主要代表来自传统Transwell模型的细胞,包括非TH特异性神经元基因,如ISL1和NEFM(图3F),显著升高的基因支持传统Transwell模型中TH神经元共表达基因的研究结果。群组5(主要代表来自器官芯片的细胞)的群体标记包括TH相关的发育基因,如LMX1A或转录因子TMEFF2, TMEFF2此前已被确定为中脑神经元存活因子(图3G)。这些综合结果表明,器官芯片产生的多巴胺能神经元比例更高、更均匀。
3、讨论
人类多能干细胞可以分化成人体内的任何组织,但为了准确研究健康和疾病中的细胞生物学,需要成熟的细胞表型。虽然iPSC衍生的二维培养长期以来一直被使用,但这种平台往往缺乏相关的多细胞复杂性和忠实的细胞成熟。相比之下,3D细胞培养模型能够更好地重现微环境,并提供优化的细胞成熟。鉴于多巴胺能神经元在成人中枢神经系统中起着许多关键作用,并且多巴胺的变化是各种神经系统疾病的基础,开发成熟多巴胺能神经元的体外培养系统可能有助于更好地了解它们在健康和疾病中的作用。
这项研究将科学家发表的在二维孔平台上生成多巴胺能神经元的方案与器官芯片系统进行了比较。现在科学家们已经证明,与传统的二维孔培养相比,新型多巴胺能神经元器官芯片能提供更成熟、更均匀的多巴胺能神经元群。通过与人类星形胶质细胞的初始共培养,克服了神经元存活率降低的问题,这种方法也被其他人用于长期培养iPSC衍生的多巴胺能神经元。传统的二维孔培养需要常规更换培养基,与之不同的是,Emulate的器官芯片系统配备了一个自动化的设备系统,可以不断为细胞提供新鲜的培养物。科学家们认为,器官芯片平台通过持续流动的培养基来补充营养物质并去除代谢废物,而不是通过二维孔培养系统间歇性地提供新鲜培养基来交换消耗的培养基,这可能是改善细胞整体健康状况和产生更成熟神经元的潜在因素。重要的是,这个自动化系统最终可以让药物等化合物通过芯片,以评估其治疗功能和穿越血脑屏障(BBB)的能力。事实上科学家们已经生成了一个源自人类iPSC的血脑屏障芯片模型,该模型可用于筛选药物输送和患者特异性药物,从而实现个性化医疗,或者重建血管神经元界面,以模拟疾病中的屏障破坏。
与传统的Transwell模型相比,器官芯片中的神经元数量较少(器官芯片中39%,传统Transwell模型中54%),而祖细胞数量较多(器官芯片中61%,传统Transwell模型中46%)。器官芯片中的祖细胞在底板中显示出高水平的共同表达,已知这些标志物会产生成熟的多巴胺能神经元。这表明器官芯片已经准备好分化为多巴胺能神经元,并且有更多的TH阳性神经元。尽管神经元群4在二维培养中高度富集,但多巴胺能标记物几乎没有表达。大多数TH阳性神经元出现在神经元群5和6中。然而,第6组(主要包括来自孔培养物的细胞)也含有额外的神经元标记物。相比之下,第5组(主要由器官芯片中的细胞组成,占18%,而二维孔中的细胞仅占1.5%)含有更特异的TH标记。此外,这些特定群体的成熟生物标志物存在一些差异。二维富集的第6组在神经祖细胞和未成熟神经元中表达较高。相比之下,器官芯片富集的第5组显示有丝分裂后神经元成熟的几种标记物的表达增加,这在二维孔培养中几乎不存在。重要的是,在器官芯片中表达TH的神经元中,超过50%同时表达关键的A9多巴胺能标记KCNJ6和SOX6。此外,器官芯片培养中多巴胺成熟标志物LMO3和NR4A2的表达水平是传统Transwell模型的两倍。这些发现共同表明,器官芯片环境可以产生更多具有A9多巴胺命运的成熟神经元。
与传统的Transwell模型相比,Emulate器官芯片平台可以优化成熟人类iPSC衍生多巴胺能神经元的生成。此外,器官芯片培养中细胞成熟度的提高已在各种细胞模型中得到证实。例如,人类iPSC衍生的胰腺β细胞表明,胰腺芯片提供了更多与生物学相关的细胞来模拟胰腺疾病,人类iPSC衍生的三维心脏细胞培养提高了细胞成熟度。
来源于患者的iPSC为人类疾病提供了一个强大的体外模型。然而,帕金森病和亨廷顿氏病等晚发性疾病的iPSC模型很难显示出稳健的表型。部分原因可能是iPSC衍生的神经元还不够成熟。多巴胺能神经元器官芯片不仅提供了更成熟的多巴胺能神经元,还为A9多巴胺能神经元提供了特异性标记。A9多巴胺能神经元是黑质中的一种亚型,控制运动功能,主要在帕金森病中退化,与腹侧被盖区的A10亚型不同,A10亚型的功能障碍与神经和精神疾病有关。例如,SOX6表达的神经元已被证明容易于与帕金森病相关的变性,并且在多巴胺能神经元器官芯片中的富集程度是孔培养的三倍。鉴于存在类似于A9的成熟多巴胺能神经元,多巴胺能神经元器官芯片显然有可能最终用于建立帕金森病模型和筛选新疗法。
目前,科学家们正在使用来自患者的iPSC来生成多巴胺能神经元器官芯片,并评估科学家们在二维孔培养中为年轻发病的帕金森病患者展示的表型。尽管器官芯片上的多巴胺能神经元以前曾被用于建立突触核蛋白病模型,但这些神经元来自商业上可获得的来源,仅在器官芯片上储存了8天,并且没有进行单细胞分析来比较二维孔和器官芯片条件。科学家们认为,在恒定流动条件下培养来自人类iPSC的多巴胺能神经元28天,为帕金森病模型的最终发展提供了重大进展,并为发现相关表型提供了理想的平台。
Emulate器官芯片包含两个独立的通道,允许多巴胺能神经元和星形胶质细胞在一个通道中共培养,而其他类型的细胞可以在另一个通道中培养,例如参与某些帕金森氏症症状的肾上腺素能神经元。帕金森病的一个重要研究领域是脑-肠轴的作用。目前正在开发的多巴胺神经元器官芯片和之前开发的肠道芯片表明,该平台是研究脑-肠轴在帕金森病中作用的理想平台,其中每种相关细胞类型都可以在各自的通道中发挥作用。最后,脑微血管内皮细胞(BMECs)可以在通道中培养,以创建用于研究药物转运的人类血脑屏障模型。尽管科学家们尚未研究BMEC与多巴胺能神经元之间的关系,但他们之前已经证明,当人类iPSC衍生的脊髓神经元与BMEC一起在脊髓芯片中培养时,神经元分化和自发神经元活动增加,从而更好地模拟肌萎缩性脊髓侧索硬化症等疾病。
总之,器官芯片平台可以从iPSCs中生成比例更大、更均匀的人类多巴胺能神经元,提供介质流动,并能够在独立通道中共同培养多种细胞类型。凭借这些特性,多巴胺能神经元器官芯片是研究多巴胺能神经元生物学的理想选择,最终可用于模拟多巴胺相关的神经系统疾病,如更好地了解帕金森病和开发新的治疗方法。
4、小结
人体细胞在血液供应持续提供营养和清除废物的环境中运作,而传统组织培养平台中的细胞在静态培养环境中生长,通常缺乏成熟度,限制了它们在健康和疾病中研究细胞生物学的实用性。相比之下,Emulate器官芯片微流控系统允许细胞在更接近体内条件的特定流动状态下生长。在这项研究中,科学家们将人类诱导多能干细胞分化为多巴胺能神经元,并评估了传统Transwell模型和器官芯片模型的细胞特征。科学家们发现,与Transwell模型相比,器官芯片培养的多巴胺能神经元比例更高、更均匀,以及更高水平的成熟生物标志物。Emulate器官芯片是研究成熟多巴胺能神经元的理想平台,可以更好地了解它们在健康和神经系统疾病中的生物学特性。
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣

