很高兴与大家分享几个月前发表于American Journal of Respiratory Cell and Molecular Biology的文章。该论文基于Emulate器官芯片技术在体外构建肺芯片模型,用于探索肺糖萼中的糖胺聚糖(如透明质酸和硫酸乙酰肝素)在细菌性肺炎中的作用。在宿主-病原体相互作用的背景下,进一步研究 GAG 脱落和重塑的机制,也为传染病研究和呼吸医学发展提供宝贵的意见。
肺上皮糖萼富含糖胺聚糖(GAG),如透明质酸和硫酸乙酰肝素。尽管这些糖胺聚糖广泛存在于肺部,但其在细菌性肺部感染中的具体作用仍不明确。为此,我们通过鼻内接种肺炎链球菌(Streptococcus pneumoniae)的小鼠模型,联合使用靶向透明质酸或硫酸乙酰肝素的酶,研究其对疾病病理、肺部炎症和肺屏障功能障碍的影响。
透明质酸和硫酸乙酰肝素的酶促降解加重了小鼠的肺炎症状,表现为疾病评分升高和肺泡中性粒细胞募集增加。此外,靶向透明质酸与肺炎链球菌感染相结合进一步加剧了全身性疾病,表现为脾脏细菌负荷和促炎细胞因子血浆浓度升高。
相反,硫酸乙酰肝素的酶解导致感染肺炎链球菌的小鼠支气管肺泡细菌负担增加、肺损伤和肺部炎症。肝素酶处理的小鼠还表现出肺屏障完整性破坏,具体表现为如肺泡水肿评分升高和血管蛋白渗漏至气道。
这一发现在Emulate人肺泡芯片模型中得到进一步验证,证实肝素酶处理在肺炎链球菌感染期间同样也会破坏人肺屏障。值得注意的是,透明质酸酶或肝素酶预处理使人上皮细胞对肺炎链球菌诱导的屏障破坏更敏感(通过跨上皮电阻测量证实),与小鼠模型结果一致。综上,完整的透明质酸和硫酸乙酰肝素对限制肺炎链球菌诱导的肺损伤、炎症反应及上皮屏障功能至关重要。
1:研究人员通过一种传统动物模型和静态细胞培养无法实现的方式,成功复制了人类肺泡毛细血管界面。这些见解为呼吸健康提供了新的视角,为改变肺炎治疗的疗法提供了可能。2:肺上皮糖萼中的透明质酸和硫酸乙酰肝素是防御肺炎链球菌感染的重要屏障,其完整性直接影响疾病严重程度。肝素酶通过增强中性粒细胞趋化因子(如CXCL1、IL-17A)的释放,促进炎症反应。糖萼破坏加速上皮屏障功能丧失(通过跨膜电阻和肺泡芯片模型验证)。1:上皮 GAG 的酶促靶向作用会加重肺炎球菌性肺炎

小鼠通过鼻内接种肺炎链球菌(S. pn.)或PBS(作为对照),同时联合透明质酸酶(Hyaluronidase, Hya)或肝素酶(Heparinase, Hep)处理。
48小时后,分析疾病进程。结果显示,与单纯感染组(S. pn. + PBS)相比,Hya和Hep处理组的小鼠体温显著下降(36 hpi),体重减轻更为明显,且肝素酶组的生存率最低。
进一步分析发现,肝素酶组的肺炎评分最高(图1E),表现为肺泡弥漫性损伤,化脓性肺炎。H&E染色结果显示,肝素酶组小鼠的肺泡内存在大量中性粒细胞浸润,同时伴有明显的肺泡结构破坏(图1F)。

通过分析BAL(支气管肺泡灌洗液)、肺组织、血液和脾脏中的细菌负荷(CFU计数),并通过观察免疫组化观察肺内细菌分布。经过酶处理的小鼠的血管周围空间中都发现有大量游离细菌。只有肝素酶处理的小鼠在支气管内和肺泡内空间中才有大量游离细菌(图2E)。
2:酶促靶向上皮 GAG 后中性粒细胞募集和炎症增强
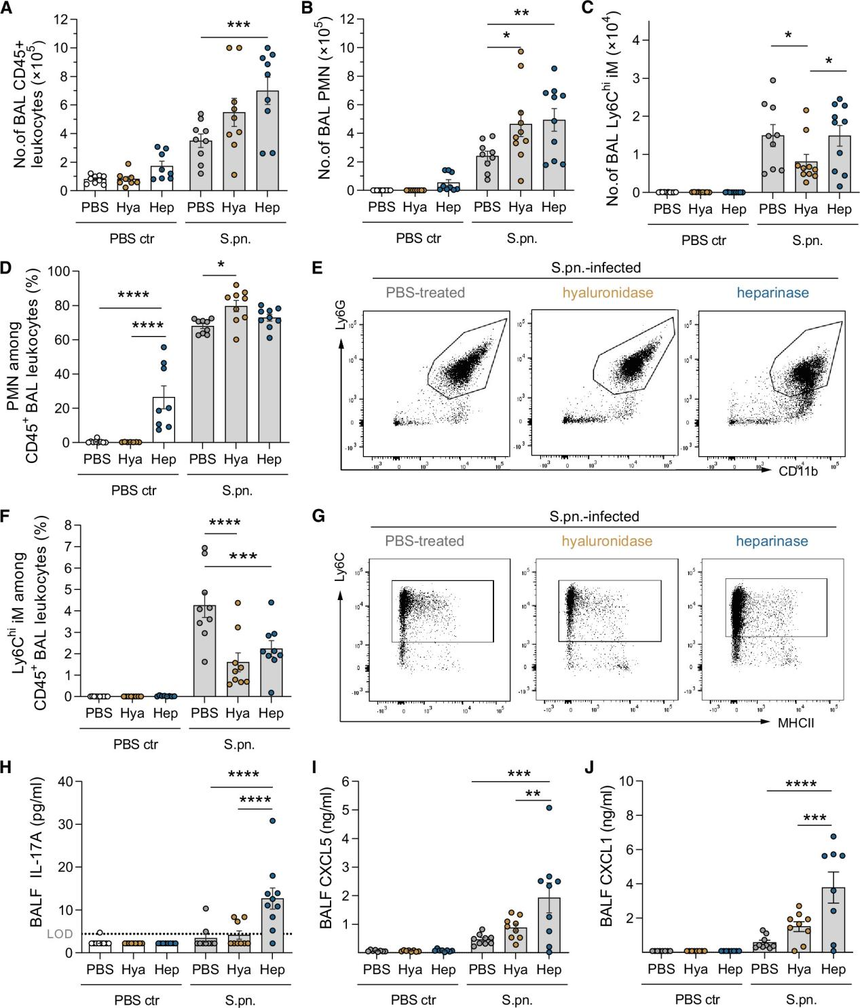
通过流式细胞术分析了BAL中CD45+白细胞、中性粒细胞(PMNs)以及Ly6Chi炎性巨噬细胞的比例,并通过ELISA检测了BAL中IL-17A、CXCL1和CXCL5的水平。
结果显示,肝素酶处理组的中性粒细胞数量显著增加,占CD45+细胞的70%以上(图3B, D)。同时,肝素酶组的IL-17A、CXCL1和CXCL5水平均显著升高,与中性粒细胞募集呈正相关(图3H-J)。相比之下,透明质酸酶处理组的Ly6Chi炎性巨噬细胞比例显著降低(图3C)。

通过观察量化BAL中IL-6、IL-1β、TNF-α、IFN-γ、CCL2浓度,酶促降解糖萼可增强促炎介质的释放。
3:链球菌性肺炎介导糖萼脱落并改变脱落的硫酸肝素的硫酸化模式

在小鼠实验中,肺炎球菌感染和肝素酶经过处理后,肝素二糖会脱落并重塑。

通过测定BAL总蛋白浓度,组织病理学评分评估血管周围和肺泡水肿,发现H&E染色观察肺泡出血。与其他组相比,肺炎链球菌感染与肝素酶处理相结合导致最严重的水肿、炎症和组织损伤。此外,只有肝素酶处理与肺炎链球菌感染相结合才导致肺泡内出血(图6D)。


通过跨上皮电阻(TEER)评估人类原代肺泡上皮细胞(HPAEC)在透明质酸酶(Hya)或肝素酶(Hep)处理后,再进行肺炎链球菌感染或模拟感染(PBS对照)后的屏障功能所有受到细菌刺激的细胞都表现出抵抗力水平的降低,这表明随着时间的推移,屏障功能丧失,并逐渐丧失活力,而酶预处理则加速这一过程(图7A和7B)。使用人类肺泡芯片模型,确定单独使用肝素酶处理会导致表观通透性略有增加;然而,与肺炎链球菌感染相结合,表观通透性水平与对照组相比显着增加(图7C),肺泡芯片的免疫荧光分析表明,肺炎链球菌感染期间的肝素酶处理会导致上皮损伤和紧密连接标志物丢失,而内皮基本保持完整(图7D)。综上所述,研究得出结论,体外糖萼的酶促破坏会导致上皮屏障通透性的快速变化,从而加速肺炎链球菌诱导的细胞毒性,而在体内,加剧的病理可能是肺屏障破坏、细菌生长增强和促炎介质共同作用的结果。
肺部的糖萼是一种薄薄的保护层,在抵御感染方面起着至关重要的作用。柏林大学医学院的研究人员利用肺泡肺芯片研究糖萼分解如何导致肺炎链球菌引起的细菌性肺炎。研究结果表明,糖萼成分(如透明质酸和硫酸肝素)的酶促降解会加剧细菌负荷、炎症和组织损伤。该研究还强调了保持糖萼完整性的潜在治疗目标,这可以减轻肺损伤并防止全身疾病进展。通过利用肺芯片技术,研究小组以传统动物模型和静态细胞培养无法做到的方式成功复制了人类肺泡毛细血管界面。这些见解为呼吸健康提供了新的视角,这使得人们能够更好地了解与人类相关的疾病机制,并为潜在的治疗干预措施提供了依据。从而可能带来更有效的治疗方法。














